【プレスリリース】核酸標的低分子創薬に新戦略
動的なDNAミスマッチ構造を標的とした全く新しい合理的医薬品設計戦略を構築
本研究のポイント
・ミスマッチ結合分子がDNAに結合した際の過渡的複合体の立体構造を決定
・超高磁場NMR、安定同位体標識、31P NMR、MicroEDを駆使し、過渡的構造をトラップする新規ミスマッチ結合分子を創造
・核酸標的低分子創薬において、過渡的複合体(中間体)をターゲットとする全く新しい合理的医薬品設計戦略を構築
概要
横浜国立大学の櫻林修平助教、児嶋長次郎教授、大阪大学産業科学研究所の中谷和彦特任教授(常勤)らの研究グループは、大阪大学蛋白質研究所、奈良先端科学技術大学の研究グループと共同で、DNAのミスマッチ塩基対を標的とする分子が一過的に形成する「過渡的複合体」の立体構造を世界で初めて可視化することに成功しました。さらに、超高磁場NMR、安定同位体標識、31P NMR、MicroEDを駆使した高精度な構造解析を通じて、複合体の安定性に寄与する相互作用因子を原子レベルで同定し、それらを基にした新たな分子の合理的設計に成功しました。
本研究は、ニューモダリティである核酸を標的とする低分子創薬研究に全く新しい合理的創薬戦略を提案するものであり、核酸標的創薬を大きく進展させると期待できます。
本研究成果は、国際科学雑誌「Journal of the American Chemical Society」(2025年4月17日付)に掲載されました。
社会的な背景
DNAのミスマッチ塩基対[用語1]は、がんやリピート病に関連する異常なDNA構造であり、創薬標的として注目されています。しかし、ミスマッチ塩基対は柔軟で動的な立体構造をとるため、複合体構造の予測や解析が難しく、ミスマッチ塩基対を特異的に認識する分子の合理的な設計は困難とされてきました。
研究成果
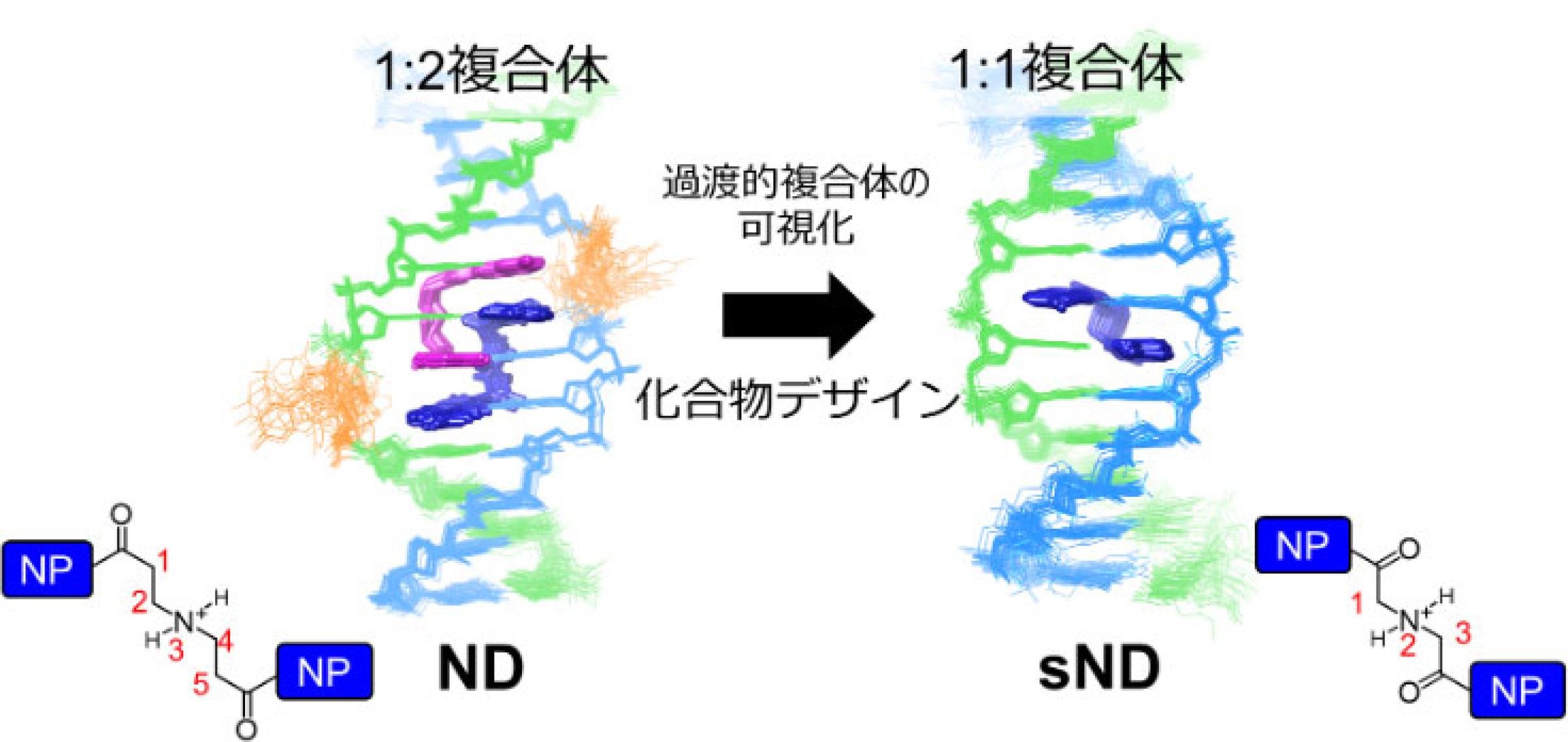
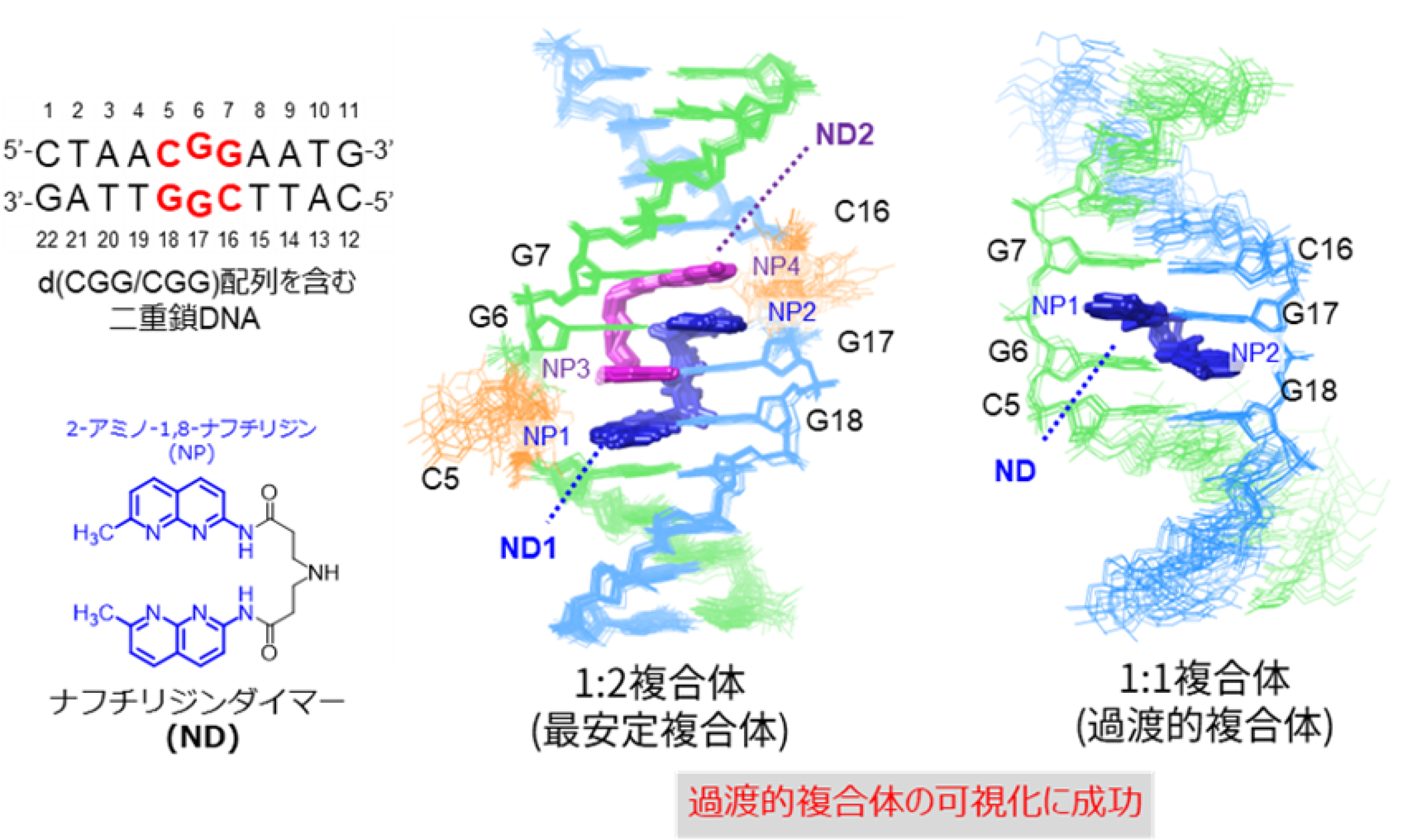
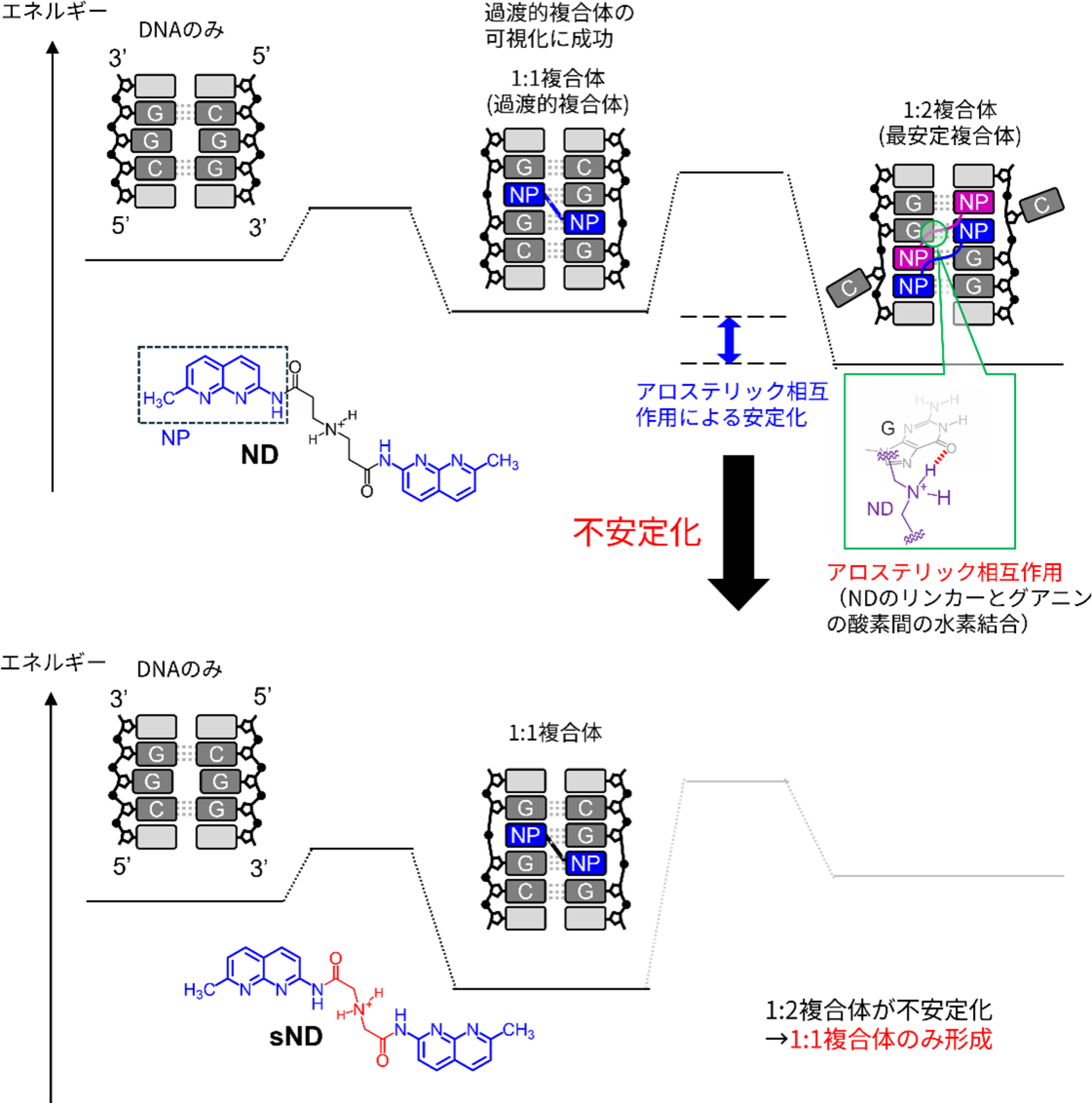
本研究では、リピート病[用語2]の1つである脆弱X症候群の原因となるd(CGG/CGG)配列に特異的に結合する薬剤ナフチリジンダイマー(ND)に着目し、これまで観測が困難だった過渡的な複合体の構造解明に取り組みました。核磁気共鳴分光法(NMR)を駆使することで、d(CGG/CGG)配列に2分子のNDが結合した最安定複合体に加え、1分子のNDが結合した過渡的複合体[用語3]の観測に成功し、その立体構造を得ました(図1)。
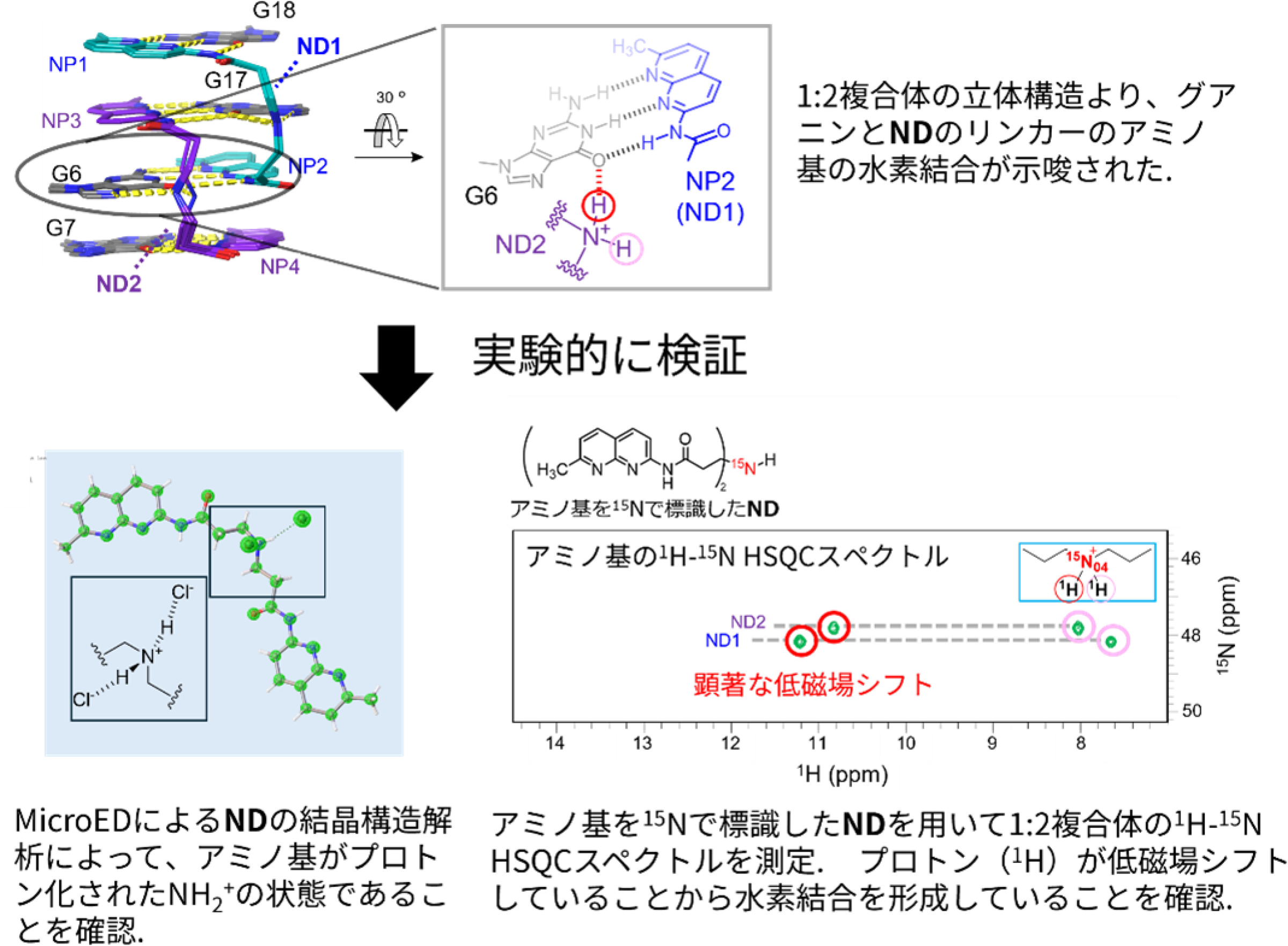
次に、なぜ1:2複合体が最も安定であるのかを検討しました。その結果、1:2複合体では、NDのリンカー部位にあるアミノ基がプロトン化され、ミスマッチ部位のグアニン塩基と水素結合を形成することでアロステリックな相互作用[用語4]が生じ、複合体の安定化に寄与していることが示唆されました。
この仮説を検証するため、MicroED[用語5]によるNDの単結晶構造解析を実施したところ、アミノ基が実際にプロトン化された状態(NH2⁺)で存在していることが確認されました。さらに、¹⁵Nで標識したNDを用いた1H-15N HSQCスペクトル[用語6]の測定によって、1:2複合体においてアミノ基の水素が顕著に低磁場側へシフトしていることから水素結合の形成が裏付けられました(図2)。
これらの構造的知見に基づき、アミノ基の相互作用を物理的に阻害するようリンカーの長さを短縮した新規分子sNDを設計・合成しました。NMRによる解析から、sNDは予測どおり1:2複合体を形成せず、1:1複合体のみを安定的に形成することが明らかとなりました(図3)。これは、動的なDNA構造に対して特定の過渡的状態を“トラップ”することに成功した分子設計例であり、核酸に対する新たな創薬戦略を示すものです。
今後の展開
本研究は、核酸-薬剤複合体の動的な構造変化を可視化・制御するための、立体構造に基づく創薬基盤の構築に寄与する成果です。特に、950 MHzをはじめとする超高磁場NMR装置や最先端のNMR解析技術を駆使することで、従来は観測が困難であった過渡的な複合体構造の可視化に成功しました。今後、同様のアプローチを他の核酸結合薬剤に展開することで、リピート病や癌など、核酸の異常に由来する疾患に対する分子標的薬の開発が期待されます。
謝辞
本研究は、日本学術振興会 科学研究費助成事業(課題番号:JP21K06047、JP22H00351、JP22H05536、JP23H02416)、文部科学省 先端研究基盤共用促進事業「NMR共用プラットフォーム(大阪大学蛋白質研究所NMR装置群)」、日本医療研究開発機構AMED 生命科学・創薬研究支援基盤事業BINDS(課題番号 JP23ama121001)、大阪大学蛋白質研究所 共同利用・共同研究拠点(課題番号:CR-23-05、MEDCR-23-02(MicroED))、日本学術振興会 科学技術イノベーション創出に向けた大学フェローシップ創設事業(課題番号:JPMJFS2125)、および、大阪大学-日本電子YOKOGUSHI協働研究所の支援を受けて行われました。
用語解説
[用語1]
ミスマッチ塩基対:通常のA-T、G-C以外の誤った組み合わせ(例:G:G、A:Aなど)。
[用語2]
リピート病:特定の数塩基の配列(例:CGG、CAGなど)が異常伸長することによって発症する疾患。
[用語3]
過渡的複合体:限られた条件で一過的に存在する複合体。
[用語4]
アロステリック相互作用:一部の相互作用が別の部位に影響を与える現象。
[用語5]
MicroED:電子線を用いた微小結晶の構造解析技術。X線で解析が難しい微小サイズの結晶でも解析が可能。
[用語6]
HSQCスペクトル:¹Hと¹⁵Nや¹Hと¹³C間の結合を観測する2次元NMRスペクトル。本研究では、アミノ基のプロトン化や水素結合の形成を調べるために用いられました。
論文情報
| 掲載誌 | Journal of the American Chemical Society |
|---|---|
| タイトル | NMR-Based Rational Drug Design of G:G Mismatch DNA Binding Ligand Trapping Transient Complex via Disruption of a Key Allosteric Interaction |
| 著者 | Shuhei Sakurabayashi, Kyoko Furuita, Takeshi Yamada, Noriaki Sugiura, Makoto Nomura, Takanori Nakane, Akihiro Kawamoto, Genji Kurisu, Yohei Miyanoiri, Toshimichi Fujiwara, Kazuhiko Nakatani,* and Chojiro Kojima* |
| DOI | 10.1021/jacs.4c17538 |
資料
研究者プロフィール
櫻林 修平![]()
大学院工学研究院 助教
児嶋 長次郎![]()
大学院工学研究院 教授
お問い合わせ先
<研究に関すること>
大学院工学研究院 教授 児嶋 長次郎
メールアドレス: kojima-chojiro-xk ynu.ac.jp
ynu.ac.jp
<報道に関すること>
総務企画部 リレーション推進課
メールアドレス: press ynu.ac.jp
ynu.ac.jp
(担当:リレーション推進課)





